近日,浙江大学爱丁堡大学联合学院(ZJE)刘坚研究员与浙江大学化学工程与生物工程学院邵世群研究员在Nature Communications国际期刊上联合发表题为A plug-and-play monofunctional platform for targeted degradation of extracellular proteins and vesicles的研究文章。该研究开发了MONOTAB(靶向配体修饰的纳米颗粒),作为一种单功能型靶向降解平台,可以有效介导细胞外蛋白的溶酶体降解。与现有的使用双功能嵌合体来招募特定的LTRs (溶酶体转运受体) 或E3连接酶来触发降解的方法不同,MONOTAB平台是以特定纳米颗粒固有的溶酶体靶向能力为基础而建立的。MONOTAB不涉及特异性受体或E3连接酶,能够克服细胞异质性或基因突变相关的耐药挑战。独特的单功能模式提供了更强的降解力。此外,MONOTAB在不损害溶酶体的情况下,有效地促进了溶酶体新生,实现了显著的蛋白质降解性能,其中MONOTAB在低纳摩尔浓度下几乎能够消除PD-L1。
原文链接:https://doi.org/10.1038/s41467-024-51720-z

目前,针对胞外蛋白降解的策略均是利用双功能嵌合体来实现的。然而,这些“双功能”嵌合体依赖于特定受体(如LTRs)或E3连接酶将靶向蛋白转运至溶酶体,这可能会致使受体表达的内在变异和受体突变或下调从而引起耐药性问题。另一个挑战是建立一个适用于多个场景的通用平台。因此,研究团队开发了MONOTAB(靶向配体修饰的纳米颗粒),这是一种即插即用的单功能降解平台,可以将细胞外靶标“拖”入溶酶体进行降解。MONOTAB利用特定纳米颗粒固有的溶酶体靶向特性,消除了对特定受体的依赖性。为了实现高模块化和可编程的平台设计,研究团队利用链霉亲和素-生物素相互作用,将抗体或其他靶向配体偶联到纳米颗粒上。研究表明,MONOTAB可以介导多种治疗靶点的有效降解,包括膜蛋白、分泌蛋白,甚至细胞外囊泡。
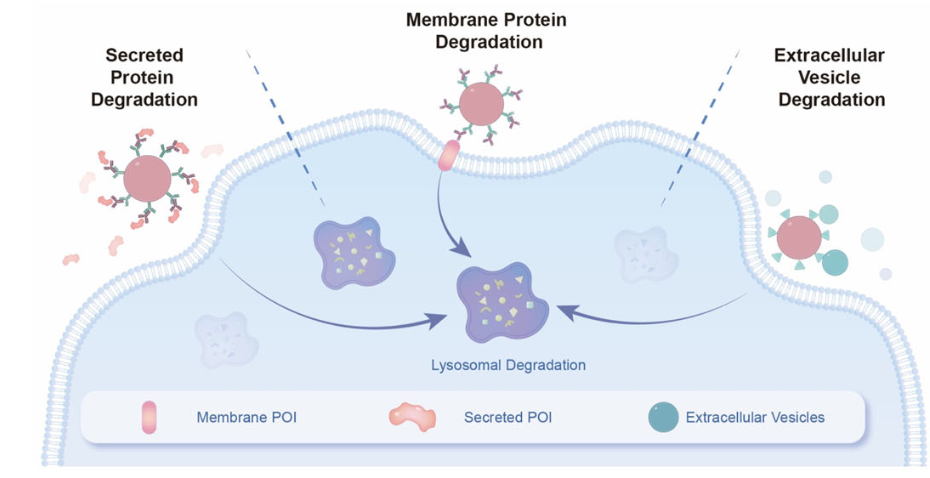
由MONOTABs介导的细胞外蛋白或囊泡的靶向降解
邵世群研究员为本文最后通讯作者,刘坚研究员为本文的共同通讯作者,ZJE 2021级生物医学专业的博士生唐倩作为共同一作参与该研究。
刘坚及课题组简介:
浙江大学研究员,博导,浙江省杰青基金获得者,浙江省高层次引进人才,浙二兼聘教授,英国爱丁堡大学荣誉PI,主持/评审国家面上基金。长期关注肺癌等肿瘤发病机制并发表相关国际论文50多篇(含通讯和一作20多篇);目前,课题组利用“干”“湿”相结合等手段研究肺鳞癌发病机制。如,鉴定肺鳞癌关键驱动基因(LKB1)和建立多组学数据库Omics3D (http://omics3d.net/)。在ZJE建立实验室以来(2020.11-至今),在Nature Metabolism、Cell Research、PNAS、Elife等期刊上发表论文20余篇,含8篇通讯作者文章(含共同)发表在Nature Communications(2)、Advanced Science、Oncogene、Molecular Oncology等国际期刊上。曾在美国贝勒医学院和NIH学习和工作12年,获得AACR 2019年度会议Travel Award青年科学家奖。
联系邮箱:JianL@intl.zju.edu.cn
课题组简介(https://person.zju.edu.cn/liujian):招聘主观能动性强的博后、博士生和研究生(含申请制的爱大单博,单硕),相关介绍(https://mp.weixin.qq.com/s/dbJrynWNatBNiMtRMPJomQ)
欢迎关注实验室创立的“肺鳞癌”公众号:LUSC_2021-








