骨肉瘤是儿童和青少年最常见的原发性恶性骨肿瘤。骨肉瘤的传统治疗方法是手术切除联合化疗或放疗。然而,化疗通常伴有严重的副作用,预后差,生存率低。此外,肿瘤缺氧作为肿瘤微环境(TME)的特征之一,严重限制了耗氧相关肿瘤疗法(如放疗和光动力疗法)的治疗效率。目前,基于纳米材料的给药系统已被开发且这类纳米给药系统能够在单一平台上集成靶向、载氧、治疗和成像等多种功能。然而,复杂的合成过程、高昂的成本和较高的毒性使该合成载药体系在生物领域的应用受到限制。因此,副作用小、疗效高、成本低、多功能的天然材料在癌症治疗中的应用近年来受到越来越多的关注。
微藻含有多种生物活性物质,如海藻多糖、β-胡萝卜素、藻蓝蛋白等,具有显著的抗肿瘤特性。此外,微藻还富含光合色素,在荧光和光声成像等生物医学成像方面具有巨大潜力。更重要的是,微藻可通过光合作用高效产生氧气,提高局部氧气浓度,有望治疗与氧气相关的疾病,如实体肿瘤和皮肤伤口。其中,一些具有特殊表面结构的微藻可用于设计药物输送系统。特别是蓝藻,如螺旋藻(Spirulina platensis,S. platensis),在细胞膜上形成了天然的水通道,以及直径约为 14-16 nm 的附加连接孔。这些天然通道允许分子在渗透压作用下扩散到 S. platensis 细胞中,使 S. platensis 成为潜在的药物载体。研究表明,小分子异硫氰酸荧光素(FITC)可通过连接孔或水通道进入螺旋藻细胞。此外,由于含有羟脯氨酸的糖蛋白分散在外层,S. platensis 的表面具有很强的电负性,可通过静电作用吸收带正电荷的聚合物或磁性纳米材料。
本研究利用螺旋藻作为药物载体,载入化疗药物阿霉素(DOX),设计了一种用于骨肉瘤治疗的多功能复合系统(SpiD)(图 1)。通过螺旋藻表面的静电吸附和表面通道,DOX分子可以有效地装载到螺旋藻中。在 650 nm激光的照射下,制备的 SpiD 可以有效地产生氧气以缓解肿瘤缺氧,并通过光敏叶绿素产生具有细胞毒性的活性氧。在此基础上,SpiD 可在肿瘤酸性环境中释放 DOX,并与活性氧协同作用,实现对骨肉瘤治疗的协同效应。此外,基于叶绿素的荧光成像显示了 SpiD 在体内的定位和分布。体外实验结果表明,SpiD 可有效产生氧气,通过光敏作用增强活性氧生成,并与 DOX 协同诱导骨肉瘤细胞死亡,体内实验也证明了 SpiD 可实现肿瘤荧光成像且在骨肉瘤内长期蓄积。组织学评估显示,SpiD+激光可下调HIF-1α,增加骨肉瘤内的活性氧水平,并通过抑制肿瘤细胞增殖、肿瘤相关血管生成和促进肿瘤细胞凋亡发挥抗肿瘤作用。
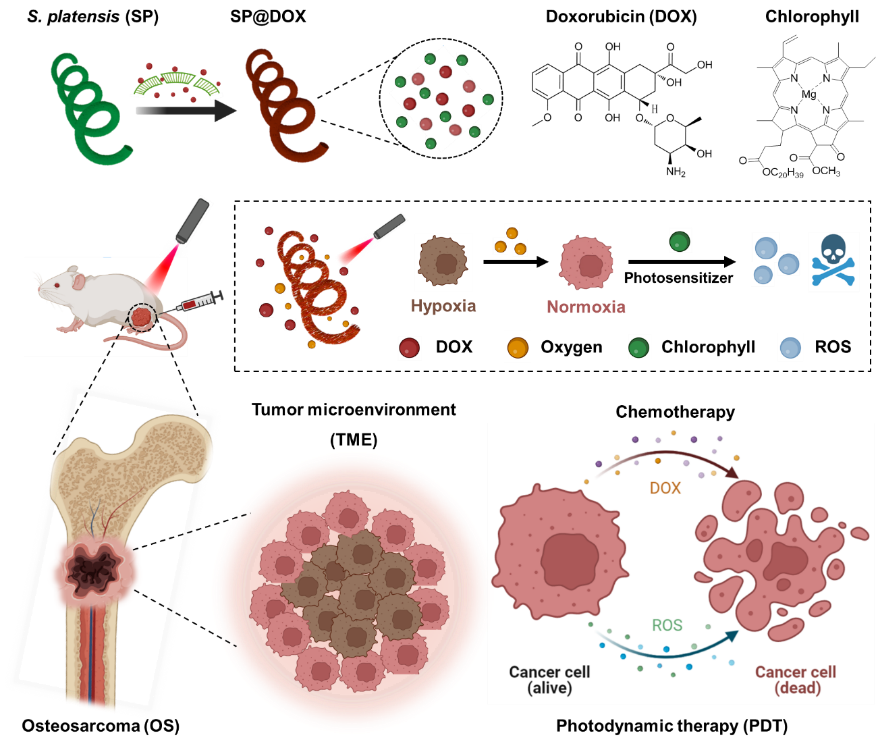
图1. 螺旋藻@阿霉素抗肿瘤复合系统用于骨肉瘤的联合化疗和光动力治疗的图示
该给药系统是一种能实现荧光成像及协同治疗的微藻给药系统。利用螺旋藻的天然生物学优势,缓解肿瘤缺氧,增强化疗和光动力疗法并减少肿瘤治疗的毒副作用。这种基于天然生物材料的给药策略成功克服了传统肿瘤治疗和纳米给药系统的局限性,为骨肉瘤的治疗提供了新的思路。
论文链接:https://pubs.acs.org/doi/10.1021/acsami.3c16995







