细胞器之间通过膜接触位点进行信号转导和物质交换,在脂质合成、钙离子传递和细胞自噬等方面发挥重要作用。线粒体作为参与多种重要生物学过程的细胞器,其与内质网的膜接触点(Mitochondria-ER contact sites, MERCs)被广泛报道。早期研究指出,线粒体融合蛋白Mitofusin1/2(MFN1/2)通过和内质网上的MFN2形成二聚体,作为线粒体和内质网膜接触位点的物理连接发挥功能。然而支持MFN2定位于内质网的数据有限,野生型MFN2在过表达状态下,超分辨成像无法检测到其在内质网上的定位,因此,MFN2能够定位至内质网并作为桥接蛋白一直是个高度值得探讨的问题。最近的发现表明MFN2能特异将磷脂酰丝氨酸(PS)从内质网转运至线粒体,合成磷脂酰乙醇胺(PE),进一步提示MFN2在线粒体和内质网膜接触点可能参与多个重要功能。这些功能是否均由MFN2-MFN2二聚体介导,是否存在其他未知的内质网蛋白和MFN2一起参与,领域内尚无定论。因此,找到内质网上和MFN2互作的新蛋白并解析其生物学功能,将帮助我们重新审视MFN2-MFN2同源二聚体介导线粒体-内质网膜接触参与多种生理功能的观点,为我们理解细胞器互作调控生命活动提供更多的视角。
基于此,浙江大学爱丁堡大学联合学院洪智实验室在JCB期刊上发表文章Dynamic interaction of REEP5-MFN1/2 enables mitochondrial hitchhiking on tubular ER。该研究首次揭示了内质网塑形蛋白REEP5,作为一个全新的MFN1/2互作蛋白,介导线粒体在管状内质网上的“搭便车(hitchhiking)”行为,最终实现线粒体在胞内的均匀分布,进而调控细胞的ROS稳态。

前人结果表明,内质网REEPs蛋白家族成员的敲降/敲除导致线粒体功能异常。因此,该研究首先做了REEPs蛋白家族的小规模筛选,发现REEP5能够特异结合MFN1/2。结合光漂白技术的活细胞成像,明确REEP5与MFN1/2富集于MERCs。利用GI-SIM超高分辨系统,观察到线粒体-内质网互作是个接触-解离-接触的动态过程,REEP5-MFN2互作促使线粒体搭载在管状内质网上被共同运输,这一运输方式被命名为“搭便车”。“搭便车”在溶酶体的运输中扮演着重要功能,而线粒体的搭便车行为尚属首次发现。研究发现减弱REEP5-MFNs之间的互作导致细胞内均匀分布的线粒体网络坍塌至细胞核外周。有意思的是,当REEP5-MFNs互作被锁定时,搭载在管状内质网上的线粒体无法随机释放,持续附着于内质网上进而导致线粒体的过度融合(hyperfusion)。操控REEP5-MFNs互作,无论是减弱还是过度增强线粒体和内质网之间的接触,都会导致线粒体分布异常。
既往研究表明,线粒体的亚细胞定位和其ROS稳态密切相关。研究团队利用线粒体定位的ROS信号传感器roGFP2和HyPer7,在REEP5-MFN1/2不同的互作强度下特异检测线粒体ROS水平,明确REEP5-MFN2介导的线粒体-内质网互作参与调控线粒体ROS稳态。
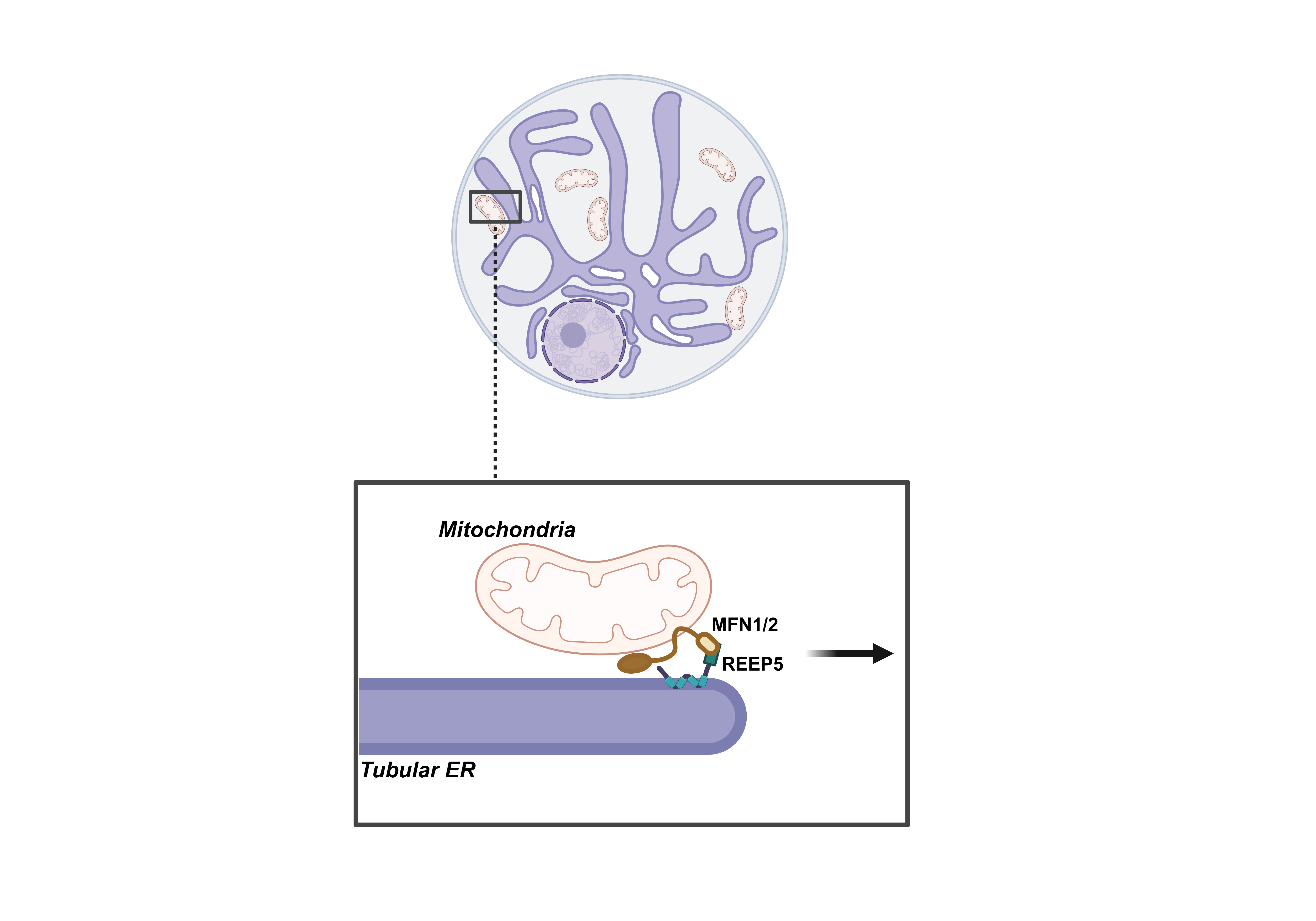
综上所述,本研究发现了REEP5-MFN1/2蛋白复合体促进线粒体在管状内质网上“搭便车”迁移的一种新模式,促进线粒体在胞内的均匀分布,进而调控细胞的 ROS 稳态。细胞器互作本质是个彼此接触继而解离的动态过程,本项目为解析这个动态过程提供了坚实的理论基础。
ZJE洪智研究员为该论文的通讯作者,陈淑娥博士和博士研究生孙扬为该论文共同第一作者。ZJE博士研究生杨岚、覃钰玲参与了该项研究。上述研究得到了国家自然科学基金项目的大力支持。
论文链接:
https://doi.org/10.1083/jcb.202304031







