三阴性乳腺癌(triple-negative breast cancer, TNBC)是一类侵袭性极强、易早发和高转移的乳腺癌亚型,约占所有乳腺癌的15%–20%。由于其雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体 2(HER2)均为阴性,临床治疗手段极为有限。化疗虽为主要治疗方式,但患者常出现快速复发及耐药性,疗效不理想。免疫检查点阻断(immune checkpoint blockade, ICB)治疗虽带来新的希望,但在晚期及转移性 TNBC 中疗效依然有限,仍迫切需要一种兼具精准递送、微环境调控及多模式治疗的新策略。
近日,浙江大学爱丁堡联合学院黄雯雯研究员团队在Advanced Science发表研究论文,报道了一种基因工程设计的光响应原位水凝胶系统,可实现转移性TNBC的免疫调控与多模式治疗。研究团队基于合成生物学与蛋白理性设计策略,构建了含半胱氨酸标签的三嵌段嵌合蛋白(cysteine-tagged silk-elastin-like proteins, cSELPs),将丝蛋白交联结构域、弹性蛋白温敏结构域与光热剂结合结构域整合于一体,实现了具有光响应性、温敏性及生物相容性的蛋白水凝胶体系。
如下图所示,该cSELP水凝胶前体溶液可在肿瘤局部实现原位凝胶化,形成稳定药物储库。通过基因工程引入的半胱氨酸位点可与金纳米棒(AuNRs)表面形成稳定的 Au–S 键,实现了无毒、稳定的光热转化性能。该体系在近红外光照射下能够触发温热PTT效应,并实现化疗药物阿霉素(DOX)与免疫检查点抑制剂抗 PD-L1(aPD-L1)的协同可控释放。通过“光热-化疗-免疫”三重治疗协同作用,诱导肿瘤细胞免疫原性死亡(immunogenic cell death, ICD),显著促进T细胞浸润与免疫激活,从而将免疫抑制型“冷肿瘤”转化为免疫活性的“热肿瘤”。
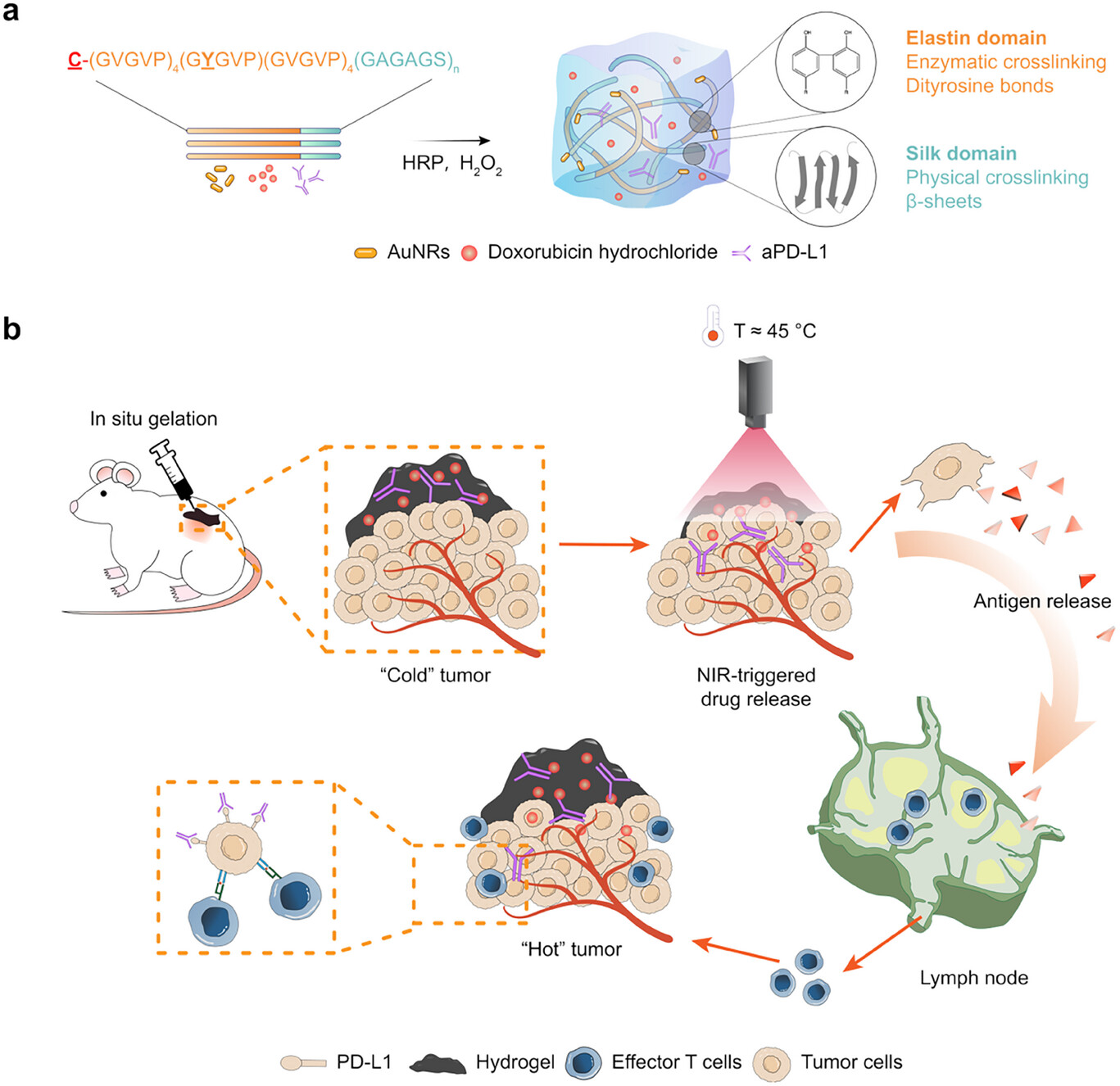
在体内实验中,c2Y@Au/DOX/aPD-L1 水凝胶体系实现了对原发与远端肿瘤的同步抑制,表现出优异的生物相容性与长期安全性。与单一治疗相比,该系统以低剂量药物与短时间光照实现显著抗肿瘤效果,且系统性毒性极低。此外,水凝胶还具备优良的抗菌性能,可扩展用于术后感染防治及创口修复等多种生物医学应用场景。
综上,黄雯雯团队通过基因工程与材料设计的深度融合,建立了一个多功能、可控、可扩展的光响应水凝胶平台,为转移性 TNBC 治疗提供了全新的思路。该体系兼具精准局部给药、免疫调控及多模式联合治疗能力,展示出广阔的临床转化潜力。
ZJE黄雯雯团队双学位博士沈忻晨为论文第一作者。ZJE黄雯雯团队张佳佳硕士、博士生欧俊含、白梓蘅硕士(现为ZJEAngelica Foggetti课题组博士生)、博士生张凯悦为论文共同作者。ZJE张倩婷团队刘桐言硕士为论文工作做出重要贡献。浙江大学医学院附属第二医院朱凯翔博士、ZJEJames Q. Wang博士、王超尘博士、张倩婷博士、鲁林荣博士为论文工作做出重要贡献。ZJE黄雯雯研究员为论文唯一通讯作者。该研究工作得到国家自然科学基金和浙江省自然科学基金等项目的资助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512355
课题组介绍

浙江大学研究员,博导,浙江省高层次人才,浙二兼聘教授,英国爱丁堡大学荣誉PI,主持多项国家自然科学基金和省部级项目。长期致力于蛋白质材料的研究,包括重组蛋白理性设计、蛋白材料加工、再生医学、肿瘤联合治疗等方面的科研工作。发表相关国际论文40余篇,H-index 29;应邀担任生物医学工程与应用国际会议地区主席及出版主席,30余个学术期刊审稿人,车用生物燃料技术国家重点实验室、李达三·叶耀珍干细胞与再生医学研究中心固定成员。
课题组运用工程技术手段,聚焦“以治病为中心”转向“以健康为中心”的新趋势,建立了以蛋白功能为导向,以生物合成和模拟预测为基础,以高通量制备分析和功能测试为验证和优化手段的重组蛋白创制平台,开展了新型生物材料设计及其临床转化的系统研究。
课题组简介:https://wenwenhuang.com/
联系邮箱: wenwenhuang@intl.zju.edu.cn
招聘主观能动性强的博后、博士生和研究生(含申请制的爱大单博单硕,相关介绍:https://biomedical-sciences.ed.ac.uk/connections-outreach/international-activities/zje-institute)。
Article Link: https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512355







