我院周民团队《Biomaterials》:超声响应性复合纳米材料用于治疗脉络膜黑色素瘤的研究
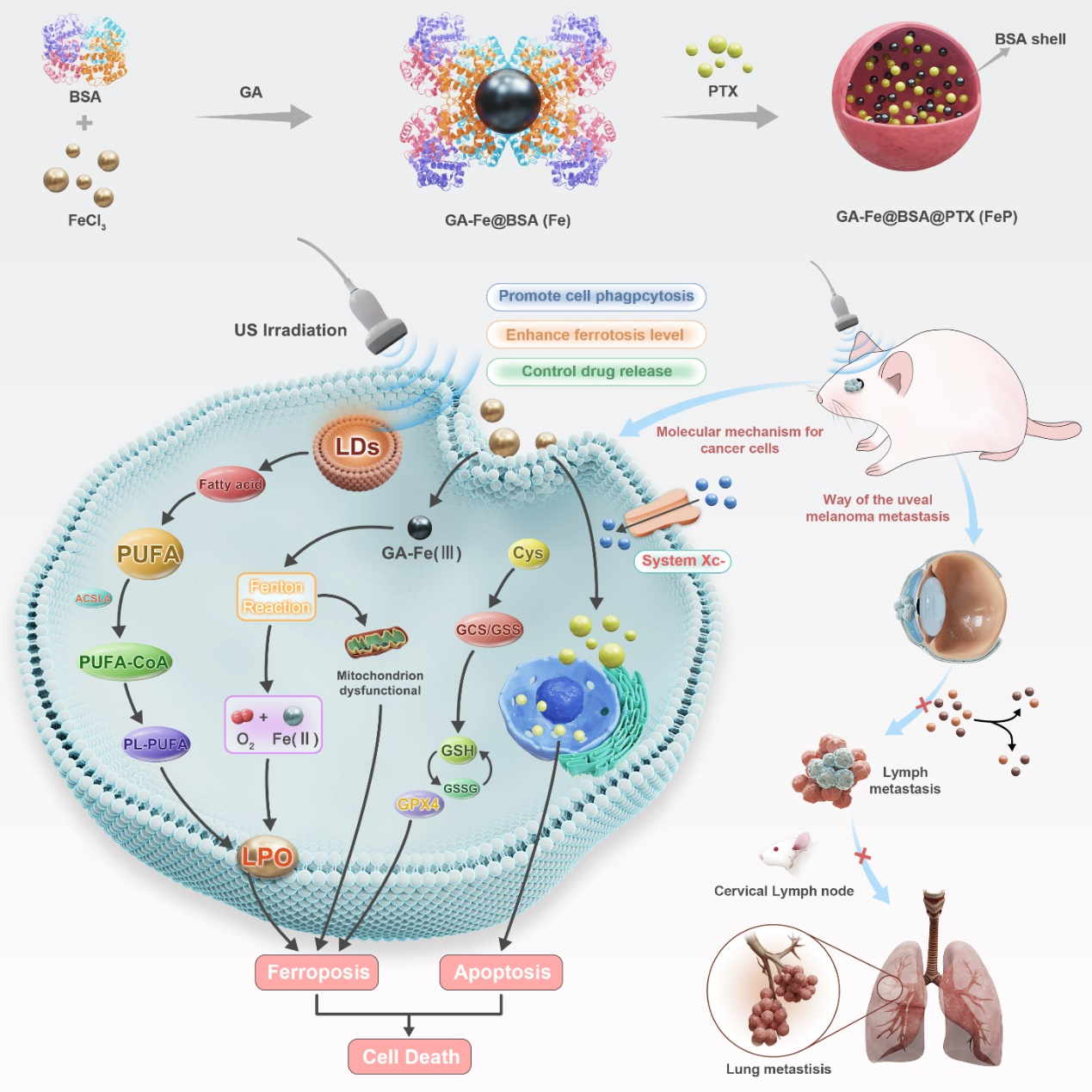
脉络膜黑色素瘤作为成年人眼内最常见的原发性肿瘤,其目前的临床诊疗现状面临多方面的挑战。主要的一线治疗方案包括手术切除术、放射治疗和眼球摘除术。然而,由于眼球生理解剖结构的复杂性,外科手术治疗在彻底清除眼底肿瘤组织方面存在极大困难,尤其是对于中晚期肿瘤。当前广泛应用的放射治疗虽然能够部分缓解症状,但却难以完全清除肿瘤组织,且对正常眼部组织造成潜在损伤,对人体健康和视觉功能造成严重影响。肿瘤远处转移是葡萄膜黑色素瘤患者死亡的主要原因之一。然而,现有的局部和全身治疗方法的疗效受限,临床发现转移后患者的死亡率高达92%,总生存期仅为3-16个月。这凸显了彻底清除残余肿瘤组织的迫切需求,以解决治疗原位肿瘤、抑制肿瘤复发和提高患者存活率的瓶颈挑战。因此,对于脉络膜黑色素瘤的有效疗法的开发显得尤为紧迫。解决这一挑战将为患者提供更有效的治疗选择,改善其生存率和生活质量。图1:超声响应复合纳米材料GA-Fe(III)@BSA@PTX(FeP NPs)用于治疗原位脉络膜黑色素瘤及肿瘤远处转移为此,浙江大学医学院附属第二医院/浙江大学爱丁堡大学联合学院周民教授/浙江大学眼科医院叶娟教授在国际知名期刊《Biomaterials》在线发表题为 “Ultrasound-Enhanced Nano catalyst with Ferroptosis-Apoptosis Combined Anticancer Strategy for Metastatic Uveal Melanoma”的研究论文。该课题报道了:利用没食子酸-Fe和紫杉醇构建的FeP NPs,强化了超声联合作用下诱导肿瘤细胞发生铁死亡联合凋亡的作用,为肿瘤治疗提供了创新性的路径。作者以牛血清白蛋白(BSA)为稳定剂,没食子酸(gallic acid, GA)为还原剂合成了超小铁纳米簇,结合紫杉醇(PTX)疏水作用,将其与多酚铁离子纳米粒GA-Fe(III)@BSA(Fe NPs)蛋白自组装,形成200 nm左右GA- Fe(III)@BSA@PTX NPs(FeP NPs)复合纳米颗粒。(图2)。在构建的复合纳米系统中,铁离子能诱导 ROS 的产生,协同超声增效后 Fe NPs + US 可不断催化·OH 的生成,诱导治疗细胞发生氧化应激级联反应,而 GSH的消耗、铁元素的蓄积及脂质过氧化反应的增强,主动触发肿瘤细胞内铁死亡反应的发生。PTX 通过诱导肿瘤细胞发生凋亡,进一步加速肿瘤细胞的死亡进程。利用以上特性,FeP NPs能够在体内有效抑制原位脉络膜黑色素瘤的生长侵袭(图3)。图2 :FeP NPs的结构,组成及形态表征在体外验证的基础上,通过建立B16F10-Luc 原位眼内荷瘤小鼠模型进行验证,构建的复合纳米材料能够在体内抑制眼内肿瘤生长的同时降低肿瘤的颈部淋巴结侵袭与肺部转移,且材料具有优良的生物安全性,这使得进一步开展其临床抗脉络膜黑色素瘤治疗的研究充满了希望。图3 :FeP NPs体内抑制原位肿瘤的疗效浙江大学眼科医院研究助理王清雅和浙江大学博士生何健为本文的第一作者与共同第一作者。浙江大学周民教授和浙江大学叶娟教授为该文章的通讯作者。上述研究得到了国家重点研发计划、国家自然科学基金、浙江省重点研发计划项目基金、创新研究院医药转化项等基金项目的大力支持。论文链接:https://doi.org/10.1016/j.biomaterials.2023.122458
2024-05-22